Энтропия одного моля вещества в его стандартном состоянии при соответствующей температуре называется стандартной молярной энтропией. Стандартная молярная энтропия обозначается символом S" и имеет размерность ДжК-1 моль-1. В табл. 5.12 указаны стандартные молярные энтропии ряда элементов и соединений при температуре 25°С. Отметим, что стандартная молярная энтропия газов, как правило, имеет намного большие значения по сравнению с энтропией твердых тел. Энтропия любого фиксированного количества вещества увеличивается в такой последовательности:
Твердое вещество= Жидкость= Газ
Стандартные молярные энтропии иногда называют абсолютными энтропиями. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в него свободных элементов. Следует также отметить, что стандартные молярные энтропии свободных элементов (в виде простых веществ) не равны нулю.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (О К) равна нулю.
Таблица 5.12. Стандартные молярные энтропии S°(298 К) (Дж/(К моль) )
| Твердые вещества | Жидкости | Газы | |||
| С (алмаз) | 2,4 | H2O | 69,9 | H2 | 131,0 |
| Cu | 33,1 | Hg | 76,0 | CH4 | 186,2 |
| SiO2 | 41,8 | Br2 | 156,6 | O2 | 205,0 |
| CuO | 43,5 | C2H5OH | 160,7 | CO2 | 213,6 |
| I2 | 116,8 | C6H6 | 173,3 | Cl2 | 233,0 |
| CuSO4 •5H2O | 360,2 | CHCl3 | 201,8 | NO2 | 239,9 |
Изменение стандартной молярной энтропии в химической реакции определяется уравнением
9)Энергия Гиббса. Стандартные значения свободной энергии. Изменение свободной энергии в химической реакции.
Энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида:
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома – страшная бессонница, которая потом кажется страшным сном. 8802 – 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Некоторые формулировки второго закона термодинамики
1. Каждая система, предоставленная сама себе, изменяется в среднем в направлении состояния с максимальной вероятностью (Г. Льюис).
2. Состояние с максимальной энтропией является наиболее устойчивым состоянием для изолированной системы (Э. Ферми).
3. При протекании любого реального процесса невозможно обеспечить средства возвращения каждой из участвующих в нем систем в ее исходное состояние (Г. Льюис).
4. Каждый физический или химический процесс в природе протекает таким образом, чтобы увеличивалась сумма энтропии всех тел, которые принимают участие в этом процессе (М. Планк).
5. Невозможна самопроизвольная передача теплоты от более холодного к более горячему телу.
6. Получение информации представляет собой уменьшение энтропии (Г. Льюис).
7. Энтропия-это стрелка времени* (А. Эддингтон).
Изменения энтропии в химических реакциях
Энтропия одного моля вещества в его стандартном состоянии при соответствующей температуре называется стандартной молярной энтропией. Стандартная молярная энтропия обозначается символом S" и имеет размерность ДжК-1 моль-1. В табл. 5.12 указаны стандартные молярные энтропии ряда элементов и соединений при температуре 25°С. Отметим, что стандартная молярная энтропия газов, как правило, имеет намного большие значения по сравнению с энтропией твердых тел. Энтропия любого фиксированного количества вещества увеличивается в такой последовательности:
Твердое вещество= Жидкость= Газ
Стандартные молярные энтропии иногда называют абсолютными энтропиями. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в него свободных элементов. Следует также отметить, что стандартные молярные энтропии свободных элементов (в виде простых веществ) не равны нулю.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (О К) равна нулю.
Таблица 5.12. Стандартные молярные энтропии S°(298 К) (Дж/(К моль) )
Изменение стандартной молярной энтропии в химической реакции определяется уравнением
Следует обратить внимание на то, что изменение энтропии в рассмотренном примере оказывается отрицательным. Этого можно было ожидать, если учесть, что, согласно уравнению рассматриваемой реакции, суммарное количество газообразных реагентов равно 1,5 моль, а суммарное количество газообразных продуктов-только 1 моль. Таким образом, в результате реакции происходит уменьшение общего количества газов. Вместе с тем нам известно, что реакции горения принадлежат к числу экзотермических реакций. Следовательно, результатом их протекания является рассеяние энергии, а это заставляет ожидать возрастания энтропии, а не ее уменьшения. Далее, следует учесть, что горение газообразного водорода при 25°С, вызванное первоначальным инициированием, протекает затем самопроизвольно и с большой интенсивностью. Но разве не должно в таком случае изменение энтропии в данной реакции быть положительным, как того требует второй закон термодинамики? Оказывается – нет или по крайней мере не обязательно должно. Второй закон термодинамики требует, чтобы в результате самопроизвольного процесса возрастала суммарная энтропия системы и ее окружения. Вычисленное выше изменение энтропии характеризует только рассматриваемую химическую систему, состоящую из реагентов и продуктов, которые принимают участие в горении газообразного водорода при 25°С. А как же вычислить изменение энтропии для окружения этой системы?
Перейдем от состояния вещества к процессам от абсолютных значений энтропий к их изменениям, обусловленным химическим взаимодействием. Зная значения стандартных энтропий можно рассчитать изменение энтропии при протекании химической реакции:
Например, для процесса протекающего при стандартных условиях
∆rS 0 298 = S 0 298
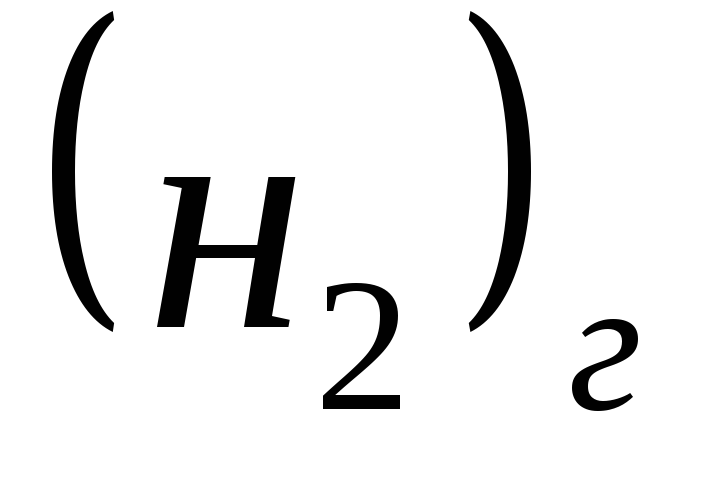
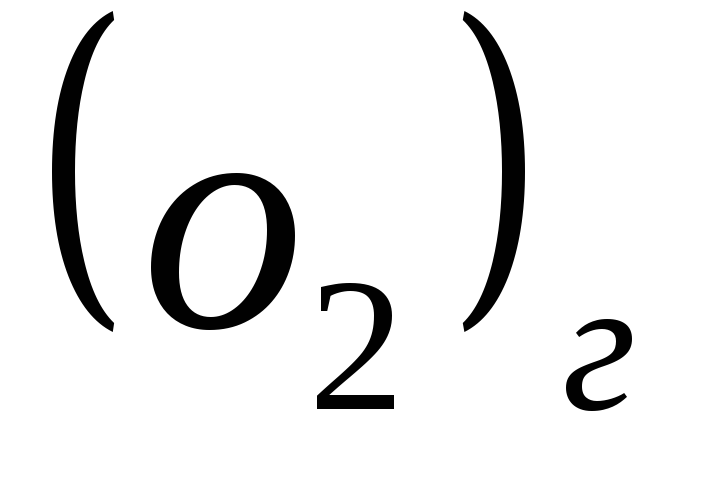
Стандартная энтропия любого вещества является положительной величиной (S 0 298 >0), изменения энтропии в процессах (∆rS) могут быть положительными, отрицательными или равными нулю.
Температурная зависимость стандартной энтропии реакции.
Стандартная энтропия реакции при Т ≠ 298 К вычисляется с учетом теплоемкостей исходных веществ и продуктов реакции.
∆rS 0 (т) = ∆rS 0 298 +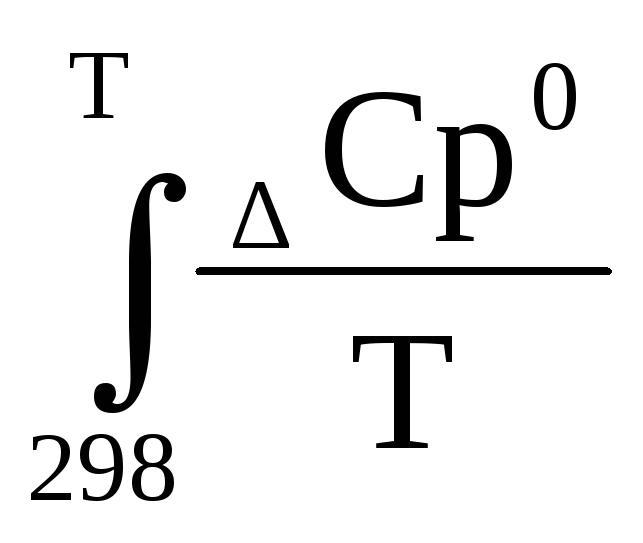
Если считать, что теплоемкость не является функцией температуры ∆Ср(Т) ≠ f(T), но после интегрирования получим:
∆rS 0 (т) =∆rS 0 298+∆Ср * ln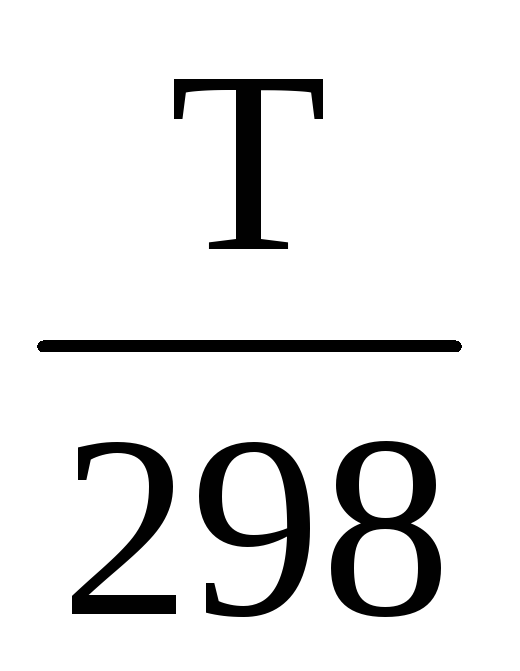
При температурной зависимости теплоемкости, которая выражается степенным рядом:
формула (1.55) принимает вид:
∆rS 0 (т) =∆rS 0 298+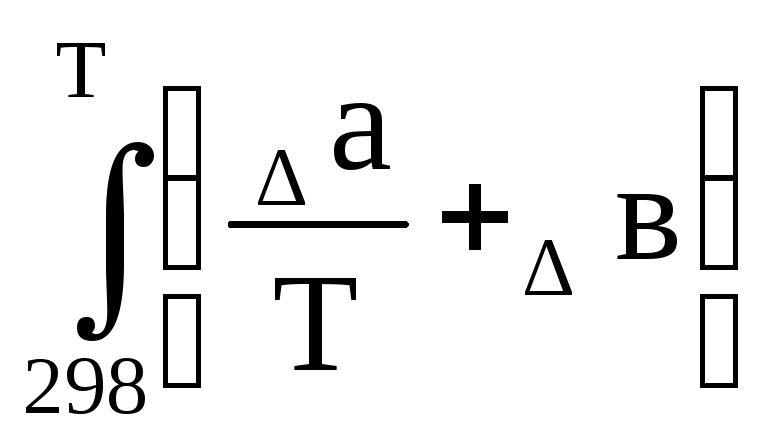

Изменение энергии Гиббса
Изменение энергии Гиббса – критерий направленности самопроизвольного процесса в закрытой системе. Реальные процессы происходят, как правило, в закрытых системах в изобарно-изотермических (р,Т = const) условиях, это наиболее типичный режим для самых различных процессов. Из уравнения (1.50) при р = const и Т = const находим
δА’ ≤ – d (U + pv – TS) р,Т (1.58)
δА’ ≤ – d (Н – TS) (1.59)
Функция G является функцией состояния системы и называется энергией Гиббса или изобарно-изотермическим потенциалом. Энергия Гиббса при р,Т = const является экстенсивным свойством системы ее абсолютные значения не поддаются вычислению.
Для обратимого процесса
δА’ = dА’ max = – (dG) р,Т (1.61)
Отсюда для обратимого (квазистатического) процесса при рассматриваемых условиях максимальная (полезная) работа (А’ max) приобретает свойства функции состояния и равна убыли энергии Гиббса.
Уравнение (1.60) можно переписать в виде Н = G + T * S, где энергия Гиббса характеризует ту часть полной энергии системы, которая может быть превращена в работу в изобарно-изотермический процесс. В этом состоит физический смысл величины G. Величина Т * S характеризует связанную энергию, т.е. ту часть полной энергии системы, которая рассматривается в окружающей среде в виде теплоты. Для установления критерия направленности самопроизвольного процесса в закрытой системе продифференцируем уравнение (1.60).
dG = dU + pdv + vdP – TdS – SdT (1.63)
Согласно выражению (1.52), ТdS ≥ dU + рdV
dU ≤ ТdS – рdV (1.64)
Подставим в уравнение (1.63) вместо dU большую либо равную ей величину ТdS – рdV получим следующие неравенство:
dG≤ – S * dТ + Vdр (1.65)
Для изобарно-изотермического процесса (р,Т = const, dp = dT = 0) выражение (1.65) примет вид (dG)р,Т ≤ 0, или для конечных изменений энергии Гиббса
Следовательно, в закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изобарно-изотермических условиях:
если ΔG= 0 (G → Gmin, энергия Гиббса достигла минимального значения), то система находится в состоянии термодинамического равновесия;
если ΔG 0, процесс в данном направлении термодинамически невозможен.
Применяя выражение (1.65) к обратимому равновесному процессу, получим
dG = – SdT + VdP (1.67)
из условия (1.67) вытекает
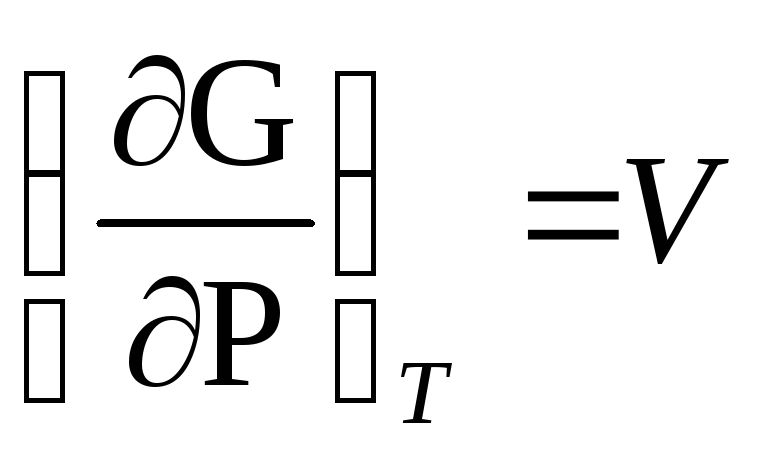

Из соотношений (1.68) следует, что объем системы, служит мерой возрастания энергии Гиббса при увеличении давления при постоянной температуре, а энтропия – мерой убыли энергии Гиббса с возрастанием температуры при постоянном объеме. Такие функции состояния, частные производные которых по соответствующим отработанным параметрам состояния в явной форме выражают другие параметры, называются характеристическими. Подставляя (1.69) в (1.60), получим
G = H + T
∆rG 0 (т) =∆rН 0 (т) + Т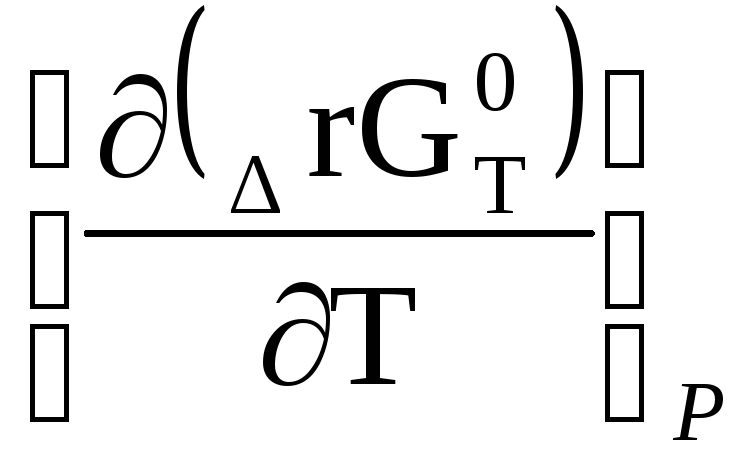
Где 
Выражение (1.70) называется уравнением Гиббса-Гельмгольца, оно связывает изменение энергии Гиббса химической реакции с ее тепловым эффектом и температурой. Иначе его можно записать в виде
Анализ уравнения (1.71) показывает, что знак и величина ∆rG 0 т зависят от двух факторов: энтальпийного –∆rН 0 т и энтропийного Т∆rS 0 т . Соотношение этих факторов определяет термодинамическую возможность самопроизвольного протекания реакции в закрытой системе прир,Т = const.
С одной стороны, в ходе химической реакции система стремиться перейти к минимальному уровню энтальпии, выделив часть ее в форме теплоты (∆rН 0 т 0 т > 0).
Если процесс протекает так, что ∆rН 0 т= 0, то рост энтропии становится единственной движущей силой. И, наоборот, при условии∆rS 0 т = 0, движущей силой процесса является убыль энтропии.
Компенсация энтропийного и энтальпийного факторов соответствует установлению равновесия в системе.
Изменение энергии Гиббса химической реакции при стандартных термодинамических условиях (р = 101,3 кПа, Т = 298 К) можно вычислить по уравнению ∆rG 0 298 =∆rН 0 298 –∆rS 0 298 * 298;
Возможен и другой путь расчета ∆rG 0 298 – по стандартным энергиям Гиббса образования исходных веществ и продуктов реакции∆fG 0 298;
∆rG 0 298 =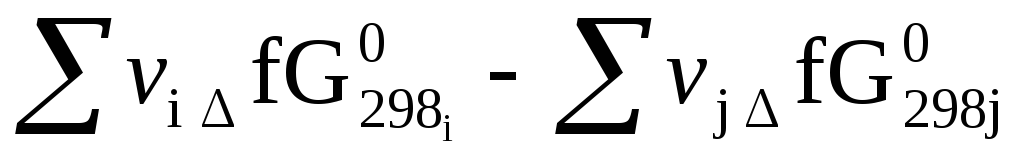
Стандартной энергией Гиббса образования вещества ∆fG 0 298называется изменение энергии Гиббса в реакции образования одного моля данного соединения из простых веществ, находящихся в термодинамически устойчивых модификациях, проведенной в стандартных термодинамических условиях.
Если в таблице нет значения ∆fG 0 298для какого-либо сложного вещества, его можно вычислить по уравнению
где ∆fН 0 298и∆fS 0 298– стандартные изменения энтальпии и энтропии соответственно в реакции образования одного моля этого соединения из простых веществ, находящихся в термодинамически устойчивых состояниях, проведенной в стандартных термодинамических условиях.
