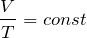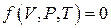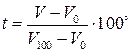Содержание
Это газ, который состоит из материальных точек, имеющих конечную массу, но не имеющих объема. Данные частицы не могут взаимодействовать на расстоянии. Столкновения частиц идеального газа описываются при помощи законов абсолютно упругого соударения шаров. Следует отметить, что имеются в виду законы столкновения именно шаров, так как точечные частицы испытывают только лобовые столкновения, которые не могут изменять направления скоростей на разные углы.
Идеальный газ существует только в теории. В реальной жизни он не может существовать в принципе, так как точечные молекулы и отсутствие их взаимодействия на расстоянии аналогично их существованию вне пространства, то есть их не существованию. Ближе всех по своим свойствам к модели идеального газа приближаются газы при малом давлении (разреженные газы) и (или) высокой температуре. Модель идеального газа подходит для изучения методов исследования систем многих частиц, знакомства с соответствующими понятиями.
В промежутках между столкновениями молекулы идеального газа движется по прямым. Законы столкновений и соударений о стенки сосудов, в которых находится газ, известны. Следовательно, если знать положения и скорости всех частиц идеального газа в какой-то момент времени, то можно найти их координаты и скорости в любой другой момент времени. Эта информация наиболее полно описывает состояние системы частиц. Однако количество частиц столь велико, что динамическое описание системы многих частиц непригодно для теории и бесполезно для практики. Это означает, что для изучения систем многих частиц информация должна быть обобщена, и ее относят не к отдельным частицам, а к их большим совокупностям.
Давление идеального газа
При помощи модели идеального газа удалось качественно и количественно объяснить давление газа на стенки сосуда, в котором он находится. Газ оказывает давление на стенки сосуда потому, что его молекулы взаимодействуют со стенками как упругие тела по законам классической механики. Количественно давление (p) идеального газа получили равным:
где 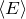
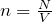
Законы идеальных газов
Идеальным называют газы, которые строго подчиняются законам Бойля – Мариотта и Гей – Люссака.
Закон Бойля – Мариотта. Для постоянной массы (m) идеального газа при постоянной температуре (T) произведение давления (p) газа на его объем (V) является постоянной величиной для любых состояний рассматриваемого вещества:
Закон Гей-Люссака. Для постоянной массы газа при неизменном давлении выполняется соотношение:
В поведении реальных газов наблюдают отступления от законов Бойля — Мариотта и Гей-Люссака, и эти отступления различны для разных газов.
Для идеального газа выполняется закон Шарля. Который говорит о том, что для постоянной массы газа, при постоянном объеме, отношение давления газа к температуре, не изменяется:
Для связи параметров идеального газа, часто используют уравнение состояния, которое носит имена двух ученых Клапейрона и Менделеева:
где 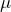

Закон Дальтона. Давление смеси идеальных газов (p) равно сумме парциальных давлений (
При этом уравнение состояния смеси идеальных газов имеет вид (2), как будто газ является химически однородным.
Примеры решения задач
| Задание | Какие процессы в неизменной массе идеального газа представляют графики (рис.1)? |
 , по условию газ идеальный, масса газа постоянная, следовательно, это изотермический процесс.
, по условию газ идеальный, масса газа постоянная, следовательно, это изотермический процесс.
Перейдем ко второму графику. Из графика мы можем сделать вывод о том, что:
где С – некоторая постоянна величина. Разделим правую и левую части выражения (1.1) имеем:
Мы получили, что давление постоянно. Так как 
| Задание | Как будет изменяться давление идеального газа в процессе при котором масса газа постоянна, объем газа увеличивают, а температуру уменьшают? |
| Решение | За основу решения задачи примем уравнение Клапейрона – Менделеева: |
Зная, что масса газа не изменяется, обозначим величину 
В этом уравнении обозначим направление изменение параметра стрелками ( 

В формуле (2.3) мы видим, что числитель дроби уменьшается, знаменатель растет, следовательно, результат (давление) в процессе уменьшается.
| Термодинамика |
|---|
 |
| Статья является частью одноименной серии. |
| Уравнение состояния |
| Идеальный газ |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Идеа́льный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах. В этой модели, во-первых, предполагается, что составляющие газ частицы не взаимодействуют друг с другом, то есть их размеры пренебрежимо малы, поэтому в объёме, занятом идеальным газом, нет взаимных столкновений частиц. Частицы идеального газа претерпевают столкновения только со стенками сосуда. Второе предположение: между частицами газа нет дальнодействующего взаимодействия, например, электростатического или гравитационного. Дополнительное условие упругих столкновений между молекулами и стенками сосуда в рамках молекулярно-кинетической теории приводит к термодинамике идеального газа 
В различных расширенных моделях идеального газа предполагается, что частицы имеют внутреннюю структуру и протяженные размеры, что можно представить частицы в виде эллипсоидов или сфер, соединённых упругими связями (например, двухатомные молекулы). Представление частиц газа в виде многоатомных молекул приводит к возникновению дополнительных степеней свободы, что побуждает учитывать энергию не только поступательного, но и вращательно-колебательного движения частиц, а также не только центральные, но и нецентральные столкновения частиц [1] .
Модель широко применяется для решения задач термодинамики газов и аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с достаточной для практических расчётов точностью хорошо описывается моделью идеального газа.
В случае очень больших давлений требуется применение более точных уравнений состояния реальных газов, например, полуэмпирического уравнения Ван-дер-Ваальса, в котором учитывается притяжение между молекулами

Различают классический идеальный газ (его свойства выводятся из законов классической механики и подчиняются статистике Максвелла — Больцмана)
 , квазиклассический идеальный газ[2] (для которого — в отличие от классического идеального газа — не выполняется закон равномерного распределения энергии по степеням свободы[3][4] ) и квантовый идеальный газ (его свойства определяются законами квантовой механики и описываются статистиками Ферми — Дирака или Бозе — Эйнштейна)
, квазиклассический идеальный газ[2] (для которого — в отличие от классического идеального газа — не выполняется закон равномерного распределения энергии по степеням свободы[3][4] ) и квантовый идеальный газ (его свойства определяются законами квантовой механики и описываются статистиками Ферми — Дирака или Бозе — Эйнштейна) .
.С термодинамической точки зрения различие между классическим и квазиклассическим идеальными газами состоит в следующем. Теплоёмкость классического идеального газа не зависит от температуры и однозначно задана геометрией молекулы газа [5] , которая тем самым определяет вид калорического уравнения состояния газа. Классические идеальные газы с одинаковой геометрией молекул подчиняются одному и тому же калорическому уравнению состояния. Теплоёмкость квазиклассического идеального газа зависит от температуры [6] [K 1] , причём эта зависимость индивидуальна для каждого газа; соответственно каждый квазиклассический идеальный газ описывается своим собственным калорическим уравнением состояния. Очень часто — в том числе и в данной статье, — когда различия между классическим и квазиклассическим приближениями не играют роли, термин «классический идеальный газ» рассматривают как синоним выражения «неквантовый идеальный газ». При макроскопическом подходе идеальными классическими и квазиклассическими газами называют гипотетические (реально не существующие) газы, подчиняющиеся термическому уравнению состояния Клапейрона [11] [12] (Клапейрона — Менделеева [13] [12] ). Иногда дополнительно указывают, что для классического идеального газа справедлив закон Джоуля [14] [15] [16] [17] . Термодинамика утверждает, что закон Джоуля выполняется для любого флюида с уравнением состояния вида p T = f ( V ) <displaystyle <frac





Популярность модели «идеальный газ» в учебных курсах термодинамики обусловлена тем обстоятельством, что результаты, получаемые с помощью уравнения Клапейрона, представляют собой не слишком сложные математические выражения и обычно допускают простой аналитический и/или графический анализ поведения входящих в них величин. Квазиклассическое приближение используют для вычисления термодинамических функций газов по их молекулярным данным [21] [22] [23] .
Содержание
История [ править | править код ]
История возникновения понятия идеальный газ восходит к успехам экспериментальной физики, начало которым было положено в XVII веке. В 1643 г. Эванджелиста Торричелли впервые доказал, что воздух имеет вес (массу), и, совместно с В. Вивиани, провёл опыт по измерению атмосферного давления с помощью запаянной с одного конца стеклянной трубки, заполненной ртутью. Так появился на свет первый ртутный барометр. В 1650 г. немецкий физик Отто фон Герике изобрёл воздушный насос и провёл в 1654 году знаменитый эксперимент с магдебургскими полушариями, наглядно подтвердивший существование атмосферного давления. Эксперименты английского физика Роберта Бойля по уравновешиванию ртутного столба давлением сжатого воздуха привели в 1662 году к выводу газового закона, названного впоследствии законом Бойля — Мариотта [24] , в связи с тем, что французский физик Эдм Мариотт в 1679 г. провёл аналогичное независимое исследование.
В 1802 году французский физик Гей-Люссак опубликовал в открытой печати закон объёмов (называемый в русскоязычной литературе законом Гей-Люссака) [25] , однако сам Гей-Люссак считал, что открытие было сделано Жаком Шарлем в неопубликованной работе, относящейся к 1787 году. Независимо от них этот закон был открыт в 1801 году английским физиком Джоном Дальтоном. Кроме того, качественно он был описан французским учёным Гийомом Амонтоном в конце XVII века. Гей-Люссак также установил, что коэффициент объёмного расширения одинаков для всех газов, несмотря на общепринятое мнение, что разные газы расширяются при нагревании различным образом.
Гей-Люссак (1822) [26] [27] [28] и Сади Карно (1824) [29] [30] [28] были первыми, кто объединил в едином уравнении законы Бойля — Мариотта и Шарля — Дальтона — Гей-Люссака. Поскольку, однако, Гей-Люссак найденным им уравнением не пользовался, а с полученными Карно результатами знакомились не по его ставшей библиографической редкостью [31] книге «Размышления о движущей силе огня и о машинах, способных развивать эту силу» [32] , а по изложению идей Карно в работе Бенуа Клапейрона «Мемуар о движущей силе огня» [33] , то и вывод термического уравнения состояния идеального газа приписали Клапейрону [34] [30] , а уравнение стали называть уравнением Клапейрона, хотя сам этот учёный никогда не претендовал на авторство обсуждаемого уравнения [28] . Не вызывает, между тем, сомнения, что именно Клапейрон первый понял плодотворность применения уравнения состояния, существенно упрощавшего все связанные с газами расчёты.
Экспериментальные исследования физических свойств реальных газов в те годы были не вполне точны и проводились в условиях не сильно отличавшихся от нормальных (температура 0 ℃, давление 760 мм рт. ст.). Предполагалось также, что газ, в отличие от пара, представляет собой субстанцию, неизменную в любых физических условиях. Первый удар по этим представлениям нанесло сжижение хлора в 1823 г. В дальнейшем выяснилось, что реальные газы представляют собой перегретые пары, достаточно удалённые от областей конденсации и критического состояния. Любой реальный газ может быть превращён в жидкость путём конденсации, либо путём непрерывных изменений однофазового состояния. Таким образом выяснилось, что реальные газы представляют одно из агрегатных состояний соответствующих простых тел, а точным уравнением состояния газа может быть уравнение состояния простого тела. Несмотря на это, газовые законы сохранились в термодинамике и в её технических приложениях как законы идеальных газов — предельных (практически недостижимых) состояний реальных газов [35] . Уравнение Клапейрона было выведено при некоторых допущениях на основе молекулярно-кинетической теории газов (Августом Крёнигом в 1856 г. [36] и Рудольфом Клаузиусом в 1857 г.) [37] . Клаузиусом было введено и само понятие «идеальный газ» [38] (в отечественной литературе конца XIX — начала XX веков вместо названия «идеальный газ» использовали термин «совершенный газ» [39] ).
Следующий важный шаг в формулировке термического уравнения состояния идеального газа — переход от индивидуальной для каждого газа постоянной к универсальной газовой постоянной — сделал русский инженер Илья Алымов [40] [30] [41] , работа которого, опубликованная в малоизвестном среди физиков и химиков издании, не обратила на себя внимание. Этот же результат был получен Менделеевым в 1874 году [39] [30] [41] . Независимо от работ русских ученых Густав Цейнер [en] (1866) [42] , Като Гульдберг (1867) [43] и Август Горстман [de] (1873) [44] пришли к выводу, что произведение индивидуальной для каждого газа постоянной в уравнении Клапейрона на молекулярный вес газа должно быть постоянной для всех газов величиной.
В 1912 году при выводе постоянной Нернста был впервые применён принцип разделения фазового пространства на равновеликие ячейки. Впоследствии в 1925 году Ш. Бозе опубликовал статью «Закон Планка и гипотеза о световых квантах», в которой развил эту идею применительно к фотонному газу. Эйнштейн сказал о данной статье, что «использованный здесь метод позволяет получить квантовую теорию идеального газа» [45] . В декабре того же года Энрико Ферми разработал статистику частиц с полуцелым спином, подчиняющихся принципу Паули, которые позднее назвали фермионами [46] [47] .
В отечественной литературе, изданной до конца 1940-х годов, термическое уравнение состояния идеального газа называли уравнением Клапейрона [48] [49] [50] [51] [52] [53] или уравнением Клапейрона для 1 моля [54] . В фундаментальной отечественной монографии 1948 года, посвящённой различным уравнениям состояния газов [55] , Менделеев — в отличие от Клапейрона — вообще не упоминается. Фамилия Менделеева в названии рассматриваемого нами уравнения появилась после начала «борьбы с низкопоклонством перед Западом» и поиска «русских приоритетов». Тогда-то и стали в научной и учебной литературе использовать такие варианты названия, как уравнение Менделеева [39] [56] , уравнение Менделеева — Клапейрона [57] [58] [59] и уравнение Клапейрона — Менделеева [56] [60] [61] [62] .
Классический идеальный газ [ править | править код ]
Молекулярно-кинетическая теория идеального газа [ править | править код ]
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
- Размеры молекул пренебрежимо малы по сравнению со средним расстоянием между ними, так что суммарный объём, занимаемый молекулами, много меньше объёма сосуда [63][64][65] ;
- импульс передаётся только при соударениях, то есть силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях [65] ;
- соударения частиц между собой и со стенками сосуда абсолютно упруги[65] ;
- количество молекул в газе велико и фиксированно, что позволяет вычислять средние величины по малому (по сравнению с размерами системы) объёму, система является эргодической, для того чтобы средние по ансамблю были равны средним по времени;
- газ находится в термодинамическом равновесии со стенками сосуда и дополнительно отсутствуют макроскопические потоки вещества. Тут следует уточнить, что градиенты термодинамических величин могут иметь место, как например при включении внешнего поля, к примеру гравитационного.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно полному импульсу, передаваемому при столкновении частиц с участком стенки единичной площади в единицу времени [65] , внутренняя энергия — сумме энергий частиц газа [66] .
По эквивалентной макроскопической формулировке идеальный газ — такой газ, который одновременно подчиняется закону Бойля — Мариотта и Гей-Люссака [64] [67] , то есть:
p V = c o n s t ⋅ T , <displaystyle pV=mathrm
где p <displaystyle p> 


ОПРЕДЕЛЕНИЕ: Идеальным газом называется газ, при рассмотрении свойств которого соблюдаются следующие условия:
а) соударения молекул такого газа происходят как соударения упругих шаров, размеры которых пренебрежимо малы;
б) от столкновения до столкновения молекулы движутся равномерно и прямолинейно;
в) пренебрегают силами взаимодействия между молекулами.
Реальные газы при комнатной температуре и нормальном давлении ведут себя как идеальные газы. Идеальными газами можно считать такие газы как гелий, водород, свойства которых уже при обычных условиях отвечают закономерностям идеального газа.
Состояние некоторой массы идеального газа будет определяться значениями трех параметров: P, V, T. Эти величины, характеризующие состояние газа, называются параметрами состояния. Эти параметры закономерно связаны друг с другом, так что изменение одного из них влечет за собой изменение другого. Эта связь аналитически может быть задана в виде функции:
Соотношение, дающее связь между параметрами какого-либо тела, называется уравнением состояния. Следовательно, данное соотношение является уравнением состояния идеального газа.
Рассмотрим некоторые из параметров состояния, характеризующих состояние газа:
1) Давление (P). В газе давление возникает в результате хаотического движения молекул, в результате которого молекулы сталкиваются друг с другом и со стенками сосуда. В результате удара молекул о стенку сосуда со стороны молекул на стенку будет действовать некоторая средняя сила dF. Предположим, что площадь поверхности dS, тогда 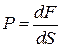
ОПРЕДЕЛЕНИЕ (механистическое): Давление – это физическая величина, численно равная силе, действующей на единицу площади поверхности, нормальную к ней.
Если сила равномерно распределена по поверхности, то 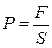
ОПРЕДЕЛЕНИЕ (предварительное): Температура тела – это термодинамическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Температура одинакова для всех частей изолированной системы, находящейся в состоянии термодинамического равновесия. Т.е., если соприкасающиеся тела находятся в состоянии теплового равновесия, т.е. не обмениваются энергией путем теплопередачи, то этим телам приписывается одинаковая температура. Если при установлении теплового контакта между телами одно из них передает энергию другому посредством теплопередачи, то первому телу приписывается большая температура, чем второму.
Любое из свойств тела (температурный признак), зависящее от температуры может быть использовано для количественного определения (измерения) температуры.
Например: если в качестве температурного признака выбрать объем и считать, что с температурой объем изменяется линейно, то выбрав за “0” температуру таяния льда, а за 100° – температуру кипения воды, получим температурную шкалу, называемую шкалой Цельсия. Согласно которой состоянию, в котором термодинамическое тело имеет объем V, следует приписывать температуру:
Для однозначного определения температурной шкалы необходимо условиться, кроме способа градуировки, также о выборе термометрического тела (т.е. тела, которое выбирается для измерения) и температурного признака.
Известны две температурные шкалы:
1) t – эмпирическая или практическая шкала температур (°C). (О выборе термометрического тела и температурного признака для этой шкалы скажем позже).
2) T – термодинамическая или абсолютная шкала (°K). Эта шкала не зависит от свойств термодинамического тела (но об этом речь пойдет позже).
Температура T, отсчитанная по абсолютной шкале, связана с температурой t по практической шкале соотношением
Единицу абсолютной температуры называют Кельвином. Температуру по практической шкале измеряют в град. Цельсия (°C). Значения град. Кельвина и град. Цельсия одинаковы. Температура равная 0°K называется абсолютным нулем, ему соответствует t=-273,15°C
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8452 – 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно